受体通常由细胞质域、跨膜域和胞外域组成。然而越来越多的研究发现,细胞外空间存在着多种多样的可溶性受体,它们通过结合胞外环境中的配体可增强或破坏细胞信号通路。在循环中,这些可溶性受体的异常水平与一系列疾病的严重程度相关联,包括自身免疫性疾病、糖尿病、传染病和癌症。
在癌症研究中,可溶性受体最近引起了人们的兴趣,因为它们在患者体液中的水平增加,有可能作为生物标志物,提供早期癌症检测、预后评估和治疗反应监测等方面的优势。除了它们的诊断价值之外,新兴证据表明,可溶性受体可能参与癌症进展、转移和逃避免疫监视。例如,细胞因子受体和免疫检查点的可溶性形式已被确定为癌症发病机制的关键调节因子。
目前,靶向可溶性受体的治疗仍处于初级阶段,但现有的数据表明可溶性受体将为癌症治疗带来新的机会。
可溶性受体的产生
鉴于可溶性受体在各种疾病的发生发展中的重要性,全面了解其产生的机制对于确定潜在的治疗靶点至关重要。
目前已知的可溶性受体是由几种不同的分子机制产生的:(1)胞外结构域脱落;(2)选择性mRNA剪接;(3)细胞外囊泡释放。
· 胞外区脱落
胞外区脱落是膜结合型受体暴露在细胞表面或细胞器上的蛋白经过蛋白酶水解然后被释放的过程。膜结合受体的水解的胞外域被释放到细胞外间隙并以可溶性形式转运。
ADAMs(蛋白分解酶和金属蛋白酶)是研究最多的剪切酶。在ADAM家族中,ADAM10和ADAM17具有相似的结构,在癌症研究中具有重要的意义。
由于受体水解而留在质膜上的短C端片段(CTF)可被γ-分泌酶蛋白复合物进一步加工处理,释放出胞内域(ICD)片段(图1)。大多数ICD被降解,但一些可被转运到多个细胞区间,如细胞核和线粒体,参与细胞间信号传递。
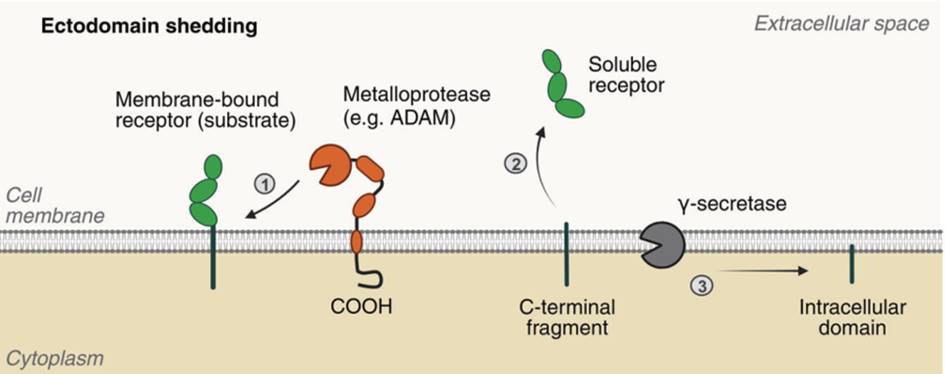
图1. 膜结合型受体的胞外结构域脱落
胞外结构域脱落是产生可溶形式的生长因子受体和许多类型的细胞因子受体的常规机制。例如,被剪切酶切割的细胞因子受体包括I类细胞因子受体,如IL-2受体、IL-6受体;TNF受体超家族和IL-1受体/Toll样受体超家族。
最近的研究表明,血清中蛋白分解酶切割产生的可溶性受体水平与患者的疾病严重程度有关。目前,大量的研究已经阐明了通过胞外结构域脱落产生的可溶性受体的机制和作用。
· 选择性mRNA剪接
可溶性受体也可以通过选择性的mRNA剪接产生,其可以去除受体中跨膜结构域编码的外显子 (图2)。
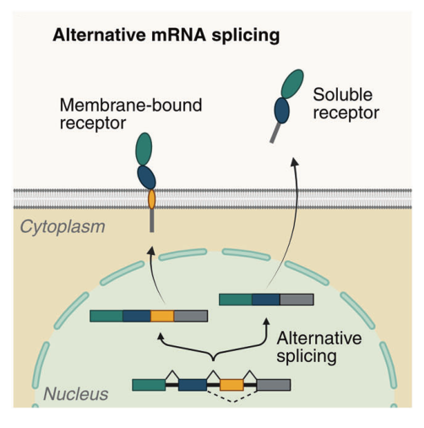
图2. 选择性mRNA剪接产生可溶性受体
最近的研究表明,许多可溶性的细胞因子受体是通过选择性剪接产生的。例如,肿瘤坏死因子受体2(TNFR2)可以通过选择性剪接产生一种没有外显子7和8的可溶性亚型,这两个外显子编码跨膜和细胞质结构域。这种可溶性的sTNFR2可以在人的血清中检测到,其水平在癌症和炎症性疾病患者中升高。
除了细胞因子受体外,几个抑制性免疫检查点已被证明通过选择性剪接以可溶形式释放。例如,可溶形式的PD-1通过外显子3的选择性剪接产生的,该外显子编码PD-1的跨膜区。CTLA-4也以可溶性形式存在,同样选择性剪切掉外显子3编码的跨膜区。这些可溶的免疫检查点可以在人血清中检测到,并用作各种癌症患者的诊断标志物。
· 细胞外囊泡释放
膜结合受体也可以作为细胞外囊泡,如微囊泡和外泌体的组分而被释放。虽然受体本身不是可溶性形式,但它可与囊泡膜结合,然后被释放到细胞外间隙中,仍然可以结合其配体(图3)。
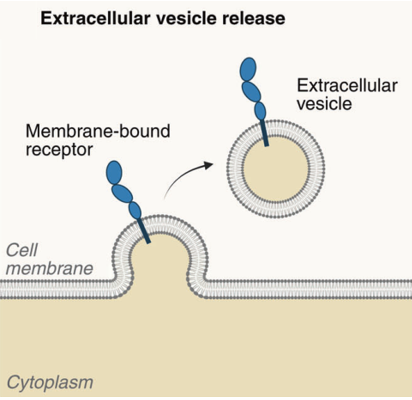
图3. 膜结合受体在细胞外囊泡中的释放
一些细胞因子受体,如TNF受体(TNFR1和TNFR2)和 IL-6R,已被检测到以完整的蛋白形式存在于细胞外囊泡上。循环中的囊泡可以影响其他细胞类型中的信号通路。据报道,肿瘤衍生的细胞外囊泡可以携带免疫抑制或免疫刺激性分子,并在其表面介导肿瘤微环境中免疫细胞的功能。ADAM蛋白酶也已在细胞外囊泡中被发现,这表明囊泡膜上的受体的胞外域可能通过ADAM在这些囊泡中被剪切和释放。
另外,细胞外囊泡,如外泌体,可以与其他细胞融合。这表明,正常情况下不表达特定受体的细胞可以在与这种囊泡融合后表达该受体。据报道,含有全长IL-6R的细胞外囊泡可以与缺乏IL-6R的细胞融合,并在靶细胞中诱导细胞信号传导。
在癌症中,含有EGFRvIII的细胞外囊泡可从胶质瘤细胞中释放出来,并转移到其他缺乏EGFRvIII的细胞中,导致表型转化。同样,含有EGFR的外泌体可以从原代胃癌细胞转移到肝基质细胞,促进肝转移。因此,具有全长受体的细胞外囊泡对肿瘤的进展至关重要。
靶向可溶性受体用于癌症治疗
可溶性受体不仅可被用作癌症诊断和预后的生物标志物,而且近年来也被用来作为癌症治疗的靶点(图4)。
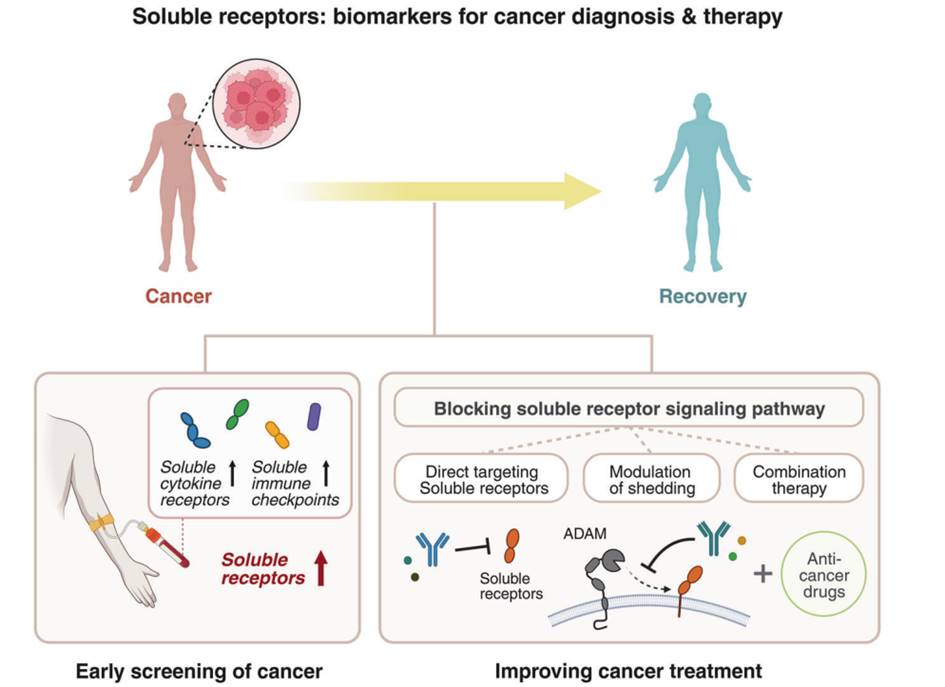
图4. 可溶性受体作为癌症诊断的生物标志物和用于治疗
· 直接靶向可溶性受体的治疗药物
直接靶向可溶性受体或其途径可能是增强抗肿瘤反应的有效治疗策略。不同类型的癌症患者中可溶性受体水平升高为通过靶向这些可溶性受体来开发新的癌症治疗方法提供了充分的证据。目前为止,已经开发出直接针对几种可溶性受体的小分子药物或单抗。
正在积极研究的治疗策略之一是阻断IL-6的反式信号。一些靶向IL-6R的人源化单抗,如tocilizumab和sarilumab,已经被开发出来抑制IL-6信号转导,目前被批准用于治疗关节炎以及正在进行其他疾病的临床试验。
然而,这些抗体的问题是,它们无法区分膜结合形式和可溶性形式的IL-6R,同时抑制IL-6经典信号和反式信号。一个可以考虑的IL-6反式信号抑制物是可溶性gp130-Fc融合蛋白(sgp130Fc)。IL-6经典信号通路即使在正常健康条件下也维持局部动态平衡;而在炎症条件下,局部IL-6经典信号通路和反式信号通路以及全身性反式信号通路都是由血液中高水平的IL-6和sIL-6R诱导的。因此,sgp130Fc选择性地仅抑制反式信号转导而不影响IL-6经典信号转导,具有治疗多种疾病的巨大潜力。
另一种直接针对可溶性受体用于癌症治疗的策略是抑制sTNFR。肿瘤微环境中表达TNFR2的Tregs增多,对卵巢癌、急性髓系白血病和肺癌等多种肿瘤具有很强的抑制作用。新的研究发现TNFR2拮抗型抗体在体外可抑制可溶性TNFR2的分泌和Treg的增殖。另外,TNFR2拮抗剂在抑制卵巢癌患者腹水中的Tregs方面比抑制健康献血者外周血中的Tregs更有效,这表明TNFR2拮抗剂对肿瘤微环境的特异性。因此,通过拮抗TNFR2来抑制肿瘤细胞Tregs的活性,进而促进肿瘤微环境中效应T细胞的增殖,抑制肿瘤生长,是一种潜在的癌症治疗方法。
· 胞外结构域脱落的调节
抑制负责膜结合受体脱落的酶可以降低可溶性受体的水平,这也可能是癌症的一种治疗策略。最近的研究表明,ADAMs的表达水平在多种癌症类型中增加。临床前研究已经报道,用于调节ADAMs的小分子化合物或单抗可以抑制肿瘤细胞的迁移、侵袭和生长。
例如,Aderbasib,一种ADAM10/ADAM17的小分子抑制剂,研究发现可以阻止HER2+乳腺癌在小鼠异种移植模型中的生长。Aderbasib也已在临床试验中进行了测试,在基于Trastuzumab的HER2+乳腺癌抑制HER2脱落治疗的I/II期试验(NCT01254136)和复发或进展性高级别胶质瘤的I期试验(NCT04295759)中取得了优异的效果。
由于ADAM酶之间高度保守的活性部位,靶向ADAM酶的催化结构域(金属蛋白酶域) 由于毒性效应已经失败。最近的研究表明,ADAM10和ADAM17的非催化结构域,特别是去整合素结构域和富含半胱氨酸的结构域,可以提供底物特异性。有望开发出对其他不同结构的ADAM家族具有更高特异性的抑制剂。
目前,有几个正在进行的靶向癌症特定ADAM酶的临床试验。例如,ADAM9靶向的ADC 药物IMGC936已在I/II期试验中用于晚期实体瘤,如非鳞状非小细胞肺癌、三阴性乳腺癌和结直肠癌(NCT04622774)。
· 现有疗法的增强剂:联合疗法
了解可溶性受体和既定治疗策略之间的相互作用可以开发更有效的治疗。目前的癌症免疫疗法虽然取得了临床上的成功,例如免疫检查点抑制剂,但相当大比例的癌症患者仍然对治疗没有反应或对抑制剂治疗耐药。
研究发现,血清中可溶性免疫检查点的水平与免疫治疗的耐药有关。例如,在晚期黑色素瘤患者中,与对照组相比,PD-1抗体(Pembrolizumab)单一疗法可提高疾病进展组血清中sLAG3的水平。此外,在用PD-1抗体(Nivolumab)和CTLA-4抗体(Ipilimumab)联合治疗后,病情进展的黑色素瘤患者的血清中sPD-1水平会增加。
这些最新发现表明,靶向可溶性免疫检查点可能对免疫治疗耐药的癌症患者有利。因此,结合现有的治疗策略和抑制可溶性受体可能是克服现有治疗方法局限性的一种解决方案。
小结
可溶性受体在癌症研究中已扮演着重要角色,它们不仅调节细胞信号通路,还在癌症进展、转移和免疫逃逸中发挥着不可或缺的作用。尽管目前的研究已经证明了可溶性受体的临床相关性,但它们的治疗应用仍未得到充分的探索。随着癌症治疗格局的演变,了解和靶向可溶性受体可能为癌症诊断、预后和治疗的新策略铺平道路。
参考文献
Soluble receptors in cancer: mechanisms, clinical significance,and therapeutic strategies.
Biological functions and therapeutic opportunities of soluble cytokine receptors.
Molecular pathways: receptor ectodomain shedding in treatment, resistance, and monitoring of cancer.













